О целебном потенциале стволовых клеток стало известно общественности в 2001 году, когда президент Джордж Буш запретил федеральное финансирование любых исследований, связанных с новыми линиями эмбриональных стволовых клеток. Это вызвало общественную и профессиональную дискуссию, сторонники которой расхваливали удивительный потенциал стволовых клеток для лечения серьезных заболеваний, в качестве примеров часто упоминались болезни Альцгеймера и Паркинсона. Критики были обеспокоены использованием человеческих эмбрионов для проведения исследований. Запрет Буша был задуман как компромисс, позволяющий проводить исследования существующих линий стволовых клеток, но запрещающий создание новых линий. Но на практике это был полный запрет, поскольку существующие линии были ограничены, а также запрет был наложен на все федеральное финансирование целого учреждения, в котором какая-либо лаборатория участвовала в запрещенных исследованиях. В результате США, вероятно, потеряли десятилетие исследований стволовых клеток.
О целебном потенциале стволовых клеток стало известно общественности в 2001 году, когда президент Джордж Буш запретил федеральное финансирование любых исследований, связанных с новыми линиями эмбриональных стволовых клеток. Это вызвало общественную и профессиональную дискуссию, сторонники которой расхваливали удивительный потенциал стволовых клеток для лечения серьезных заболеваний, в качестве примеров часто упоминались болезни Альцгеймера и Паркинсона. Критики были обеспокоены использованием человеческих эмбрионов для проведения исследований. Запрет Буша был задуман как компромисс, позволяющий проводить исследования существующих линий стволовых клеток, но запрещающий создание новых линий. Но на практике это был полный запрет, поскольку существующие линии были ограничены, а также запрет был наложен на все федеральное финансирование целого учреждения, в котором какая-либо лаборатория участвовала в запрещенных исследованиях. В результате США, вероятно, потеряли десятилетие исследований стволовых клеток.
Запрет Буша был отменен Обамой в 2009 году. Возможно, что еще более важно, начиная с 2007 года ученые публиковали исследования, показывающие, как превратить взрослые клетки в плюрипотентные стволовые. Они не так хороши, как эмбриональные стволовые клетки, которые являются тотипотентными (плюрипотентные могут превращаться в клетки любого типа в организме, в то время как тотипотентные могут превращаться в клетки любого типа, включая клетки плаценты). Но они близки, а также чрезвычайно полезны. В течение следующего десятилетия эти исследования продолжались, и были найдены новые и более простые способы преобразования взрослых клеток в плюрипотентные стволовые клетки, называемые “индуцированными” плюрипотентными стволовыми клетками (iPSC). У этих клеток также есть потенциальное преимущество – они могут быть взяты у человека для использования у этого человека, и, следовательно, исключается проблема отторжения.
На протяжении последних двух десятилетий, несмотря на запрет, стволовые клетки рекламировались как потенциальное средство от всех болезней, способное заменять или регенерировать ткани и полностью излечивать даже самые тяжелые дегенеративные заболевания. Но реальность не оправдала ожиданий. Существует множество технических препятствий для использования стволовых клеток таким образом – они должны выживать и даже процветать, выполнять свои желаемые функции, образовывать анатомические структуры или соединения с другими клетками и не превращаться в опухоли. Последнее обстоятельство стало серьезным препятствием для их терапевтического использования.
Читатели этого блога, однако, узнают общую черту в прогнозировании будущего технологического прогресса – существует тенденция переоценивать краткосрочный прогресс и недооценивать долгосрочный прогресс. Два десятилетия назад казалось, что стволовые клетки близки к революции в медицине, по крайней мере, в глазах общественности, но эксперты знали или должны были знать, что барьеры на этом пути существенны. В то время на проработку технических деталей требовалось 2-4 десятилетия, но эта трезвая оценка редко доводилась до сведения общественности. Однако, как только технические препятствия устраняются, потенциал часто превосходит даже оптимистичные прогнозы. Со стволовыми клетками у нас пока не все в порядке, и, возможно, до завершения разработки этой технологии еще десятилетия. Но мы постоянно прогрессируем.
На этой ноте, вот исследование, подтверждающее концепцию, которое действительно кажется многообещающим, с использованием ИПСК на крысиной модели для лечения болезни Паркинсона (БП). БП – это нейродегенеративное заболевание, при котором отмирает определенный тип нейронов (клеток головного мозга). Нейроны – это особый тип клеток мозга, которые устанавливают длинные связи с другими нейронами и взаимодействуют с ними электрохимически, посредством как электрических, так и химических сигналов. Нейроны, о которых идет речь, находятся в части мозга, называемой черной субстанцией (в частности, компактной частью), названной так из-за своего темного или черного цвета. Эта структура является частью более крупной цепи, называемой экстрапирамидной системой, которая в основном расположена в базальных ганглиях глубоко в головном мозге. Эта цепь участвует в регулировании мгновенной плавности произвольного мышечного контроля. Это схема обратной связи, тщательно регулирующая усиление связи между сознательным желанием двигаться и результатом движения. Увеличьте громкость, и люди будут корчиться и двигаться непрерывно, уменьшите громкость, и они будут двигаться все медленнее и медленнее, вплоть до того, что совсем застынут. Пациенты с БП двигаются медленно (это называется брадикинезией), что также затрудняет ходьбу, может повлиять на речь, выразительность лица, а также вызвать тремор.
Нейроны компактной части мозга выделяют нейрохимический дофамин, и поэтому одним из методов лечения БП является простое введение предшественника дофамина, чтобы максимально увеличить количество, которое могут выделять выжившие нейроны. Но по мере того, как теряется все больше и больше нейронов, эта стратегия становится все менее эффективной. В конце концов, нейронов, отвечающих за выброс дофамина, не остается, и пациенты начинают двигаться, что отражает уровень препарата в их крови. Поэтому они постоянно переходят от гиперкинеза к брадикинезу, с короткими периодами, когда все в порядке.
На протяжении десятилетий нейробиологи пытались лечить БП путем имплантации в мозг клеток, которые непосредственно высвобождали бы дофамин. В 1979 году были опубликованы две статьи, в которых демонстрировался потенциал пересадки мозговой ткани плода в мозг пациентов с БП. Но эти клетки не устанавливали значимых связей, они просто высвобождали дофамин локально. По сути, это была система доставки лекарств. Кандидатами были только избранные пациенты, это была сложная инвазивная операция, и долгосрочное выживание трансплантированных клеток было огромной проблемой. Таким образом, хотя для некоторых пациентов это оставалось выбором, оно не произвело революции в лечении БП и не представляло собой ничего близкого к “излечению”.
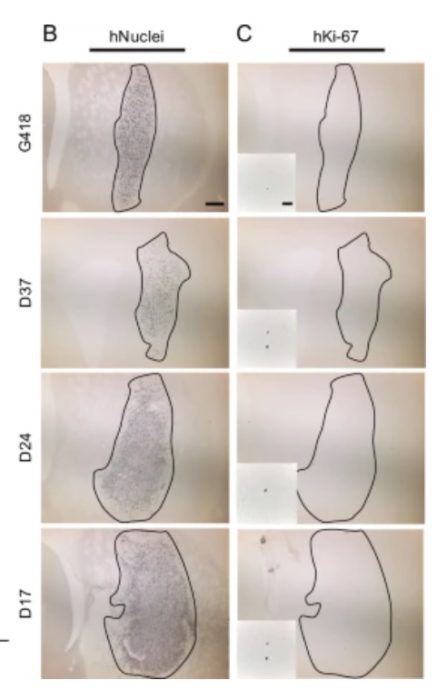
Следующим очевидным шагом являются стволовые клетки – трансплантация запрограммированных нейронов, которые, теоретически, могут подключаться к цепи, а не просто выделять дофамин, регулируя выделение дофамина, восстанавливая нормальную функцию. Это оказалось очень сложным, но недавнее исследование на крысах кажется многообещающим. Исследователи использовали клетки кожи взрослого человека, а затем преобразовали их в ИПСК. Они специально пытались определить оптимальное время для двухэтапного процесса. Сначала необходимо провести дифференцировку клеток в стволовые, а затем запрограммировать их на превращение в нейроны. Время проведения каждой процедуры имеет решающее значение. Они обнаружили, что оптимальным сроком для первого этапа является 17 дней. Они использовали эти клетки, затем дифференцировали их в нейроны и пересадили крысам с генетической формой БП. Клетки выжили, установили связи, выделили дофамин и уменьшили симптомы БП у крыс. Кроме того, наблюдался хороший эффект “доза-ответ”. У тех крыс, которым вводили мало клеток, наблюдался умеренный эффект, в то время как у крыс с имплантатами большего размера практически не было никаких признаков БП. Возможно, самое главное, что в результате они не обнаружили образования каких-либо опухолей.
Следующий шаг – испытания на людях с тем же типом генетической патологии. Хотя эти результаты и впечатляют, теперь мы знаем, что не стоит слишком волноваться. Пока мы не проведем исследования на людях, мы не знаем, будет ли это лечение эффективным. Во-первых, человеческий мозг намного больше мозга крысы, а это означает, что пересаженные нейроны должны устанавливать связи на гораздо больших расстояниях. Это немаловажный фактор, который может оказаться губительным для данного подхода. Если аксоны не найдут свои мишени и не сформируют замкнутую цепь, лечение не будет работать должным образом. Кроме того, потребуется больший объем клеток, и нам нужно посмотреть, влияет ли это на вероятность образования опасных опухолей.
Короче говоря, хотя это лечение, по-видимому, работает на крысах, переход от крысиного мозга к человеческому является непростой задачей. Поэтому мы можем надеяться, но пока не радоваться. Клинические испытания, скорее всего, займут годы, и если этот подход не сработает, придется вернуться к чертежной доске, и может пройти еще десять лет, прежде чем мы дойдем до этой точки. Конечно, я очень надеюсь, что это сработает идеально. Если это произойдет, мы, возможно, наконец-то приблизимся к тому моменту, когда мы осознаем часть ажиотажа вокруг стволовых клеток, который был 20-летней давности. Но не удивляйтесь, если на это уйдет еще 20 лет.